2. Información microbiológica coronavirus
2.1 Características generales de los coronavirus
Los coronavirus son miembros de la subfamilia Orthocoronavirinae dentro de la familia Coronaviridae (orden Nidovirales) (11). Esta subfamilia comprende cuatro géneros: Alphacoronavirus, Betacoronavirus, Gammacoronavirus y Deltacoronavirus de acuerdo a su estructura genética. Los alfacoronavirus y betacoronavirus infectan solo a mamíferos y normalmente son responsables de infecciones respiratorias en humanos y gastroenteritis en animales. Hasta la aparición del SARS-CoV-2, se habían descrito seis coronavirus en seres humanos (HCoV-NL63, HCoV-229E, HCoV-OC43 y HKU1) que son responsables de un número importante de las infecciones leves del tracto respiratorio superior en personas adultas inmunocompetentes, pero que pueden causar cuadros más graves en niños y ancianos con estacionalidad típicamente invernal (96–98).
El SARS-CoV y MERS-CoV, ambos patógenos emergentes a partir de un reservorio animal, son responsables de infecciones respiratorias graves de corte epidémico con gran repercusión internacional debido a su morbilidad y mortalidad.
Coronavirus SARS-CoV-2 supone el séptimo coronavirus aislado y caracterizado capaz de
provocar infecciones en humanos.
Estructuralmente los coronavirus son virus esféricos de 100-160 nm de diámetro, con envuelta y que contienen ARN monocatenario (ssRNA) de polaridad positiva de entre 26 y 32 kilobases de longitud. El genoma del virus SARS-CoV-2 codifica 4 proteínas estructurales: la proteína S (spike protein), la proteína E (envelope), la proteína M (membrane) y la proteína N (nucleocapsid).
La proteína N está en el interior del virión asociada al RNA viral, y las otras cuatro proteínas están
asociadas a la envuelta viral. La proteína S se ensambla en homotrímeros, y forma estructuras que sobresalen de la envuelta del virus. La proteína S contienen el dominio de unión al receptor celular y por lo tanto es la proteína determinante del tropismo del virus y además es la proteína que tiene la actividad de fusión de la membrana viral con la celular y de esta manera permite liberar el genoma viral en el interior de la célula que va a infectar (99,100).
2.2. Características de SARS-CoV-2
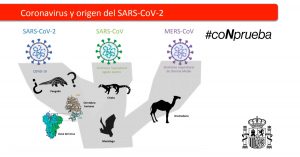
Aún no está claro su origen, pero los estudios filogenéticos revisados hasta la fecha de este informe apuntan a que muy probablemente el virus provenga de murciélagos y que de allí haya pasado al ser humano a través de mutaciones o recombinaciones sufridas en un hospedador intermediario, probablemente algún animal vivo del mercado de Wuhan (donde aparte de marisco se vendían otros animales vivos). Se planteó que este animal pudiera ser el pangolín sin que se haya llegado a una conclusión definitiva (5,101).
El virus causante de los primeros 9 casos de neumonía descritos de ciudadanos de Wuham (China) se aisló de estos pacientes y se secuenció (38). En total, se pudo obtener la secuencia genómica completa de 7 de estas muestras, más dos secuencias parciales de las otras dos muestras. Los genomas completos secuenciados de estos eran prácticamente idénticos entre sí con un porcentaje de homología del 99%, lo que apoya la idea de que es un virus de muy reciente introducción en la población humana. Tras realizar el análisis filogenético de estas secuencias, se observó una alta homología con virus del género Betacoronavirus, concretamente un 88% de identidad con dos coronavirus aislados de murciélagos en 2018. Estas secuencias mostraron, sin embargo, una homología de secuencia menor con el virus SARS (79%) y el virus MERS (50%). Esta diferencia con el SARS-CoV se consideró suficiente como para clasificar a este patógeno designado como SARS-CoV-2 como un nuevo miembro del género Betacoronavirus. Una diferencia notable es que la proteína S del nuevo coronavirus es más larga que sus homologas de murciélago, pero
también que las proteínas S del SARS-CoV y MERS-CoV. El SARS-CoV penetra en la célula
empleando como receptor a la enzima convertidora de angiotensina 2 (ACE-2).
Aunque la estructura de la glicoproteína de la envoltura del SARS-CoV-2 es ligeramente diferente de la del SARS-CoV, se ha demostrado in vitro que el ACE-2 sigue siendo un receptor válido para el SARSCoV-2 (103). Además, dos estudios por crioelectro-microscopia electrónica han determinado la estructura de la proteína S unida a la proteína ACE-2 (104,105). Se han determinado las estructuras tridimensionales de dos proteínas del virus: la RNA polimerasa del virus (106) y la proteasa principal del virus (denominada Mpro o 3CLpro) (107). El conocimiento de la conformación tridimensional de proteínas virales es muy útil para el desarrollo de antivirales. Esto Información científica-técnica. Enfermedad por coronavirus, COVID-19 28 de agosto de 2020
se realiza con la ayuda de programas informáticos que permiten el diseño de moléculas que encajen en sitios vitales de las proteínas y por tanto impidan que realicen su función.
2.3. Variantes y filogenia
Pese a que existe una gran homología entre los genomas completos de SARS-CoV-2, se han detectado varias mutaciones respecto a la considerada secuencia de referencia. La identificación con una mayor frecuencia de determinadas homoplasias (mutaciones repetidas surgidas de manera independiente) podría considerarse un indicio de que el virus se encuentra en fase de
atención de los investigadores es la mutación D614G en la proteína S que ha sido relacionada con una mayor capacidad de transmisión (109–114). Consecuentemente con esta ventaja adaptativa, esta variante se ha impuesto a las cepas que no presentan esta mutación a nivel global Figura 10. La transición global de la forma D614 original a la variante G614. Promedio de recuentos
semanales de secuencias muestreadas que exhiben las variantes D614 (naranja) y G614 (azul) en diferentes continentes entre el 12 de enero y el 12 de mayo de 2020. Fuente: Korber et al (109).
La posible relación entre esta y otras mutaciones con la severidad no está claramente establecida. Algunos estudios han relacionado la mutación D614G con una mayor letalidad (115,116), mientras que otros no han encontrado diferencias. Dado que afecta al RBD (dominio de unión al receptor) de la proteína S, principal objetivo de las posibles vacunas en desarrollo, cabría la posibilidad de que esta mutación tuviera algún impacto sobre la efectividad de las vacunas. En este sentido, un estudio que analiza la capacidad in vitro de neutralización de sueros humanos, de primates no humanos y de ratones inmunizados con una vacuna mRNA frente a pseudovirus que presentaban bien la variante 614D o la variante 614G demostró que los pseudovirus con la variante 614 G eran moderadamente más sensibles a la neutralización (117). También se han publicado algunos ensayos en los que se enfrentó la variante Información científica-técnica. Enfermedad por coronavirus, COVID-19 28 de agosto de 2020 614G a sueros humanos obtenidos de pacientes convalecientes: uno de ellos, que analizó cuatro sueros monoclonales frente al dominio RBD, no apreció ninguna disminución en la sensibilidad del virus mientras que otros ensayos encontraron una disminución en la capacidad de neutralización en un 7% de los sueros estudiados (41 en uno de los estudios y 70 en el otro) (111,118).
Otro grupo de mutaciones destacadas son las delecciones que afectan a la región ORF 8. Entre ellas, la mejor estudiada ha sido la variante 382, detectada en un brote en Singapur en enero y
febrero de 2020. Una delección en esta misma región en SARS-CoV (responsable de la epidemia de SARS de 2002-2003) se relacionó con una menor capacidad de replicación y se propuso la hipótesis, no demostrada, de que implicara una atenuación de la severidad. Recientemente, un estudio confirmó una sintomatología más leve y una menor liberación de mediadores proinflamatorios en pacientes infectados con la variante 382.
Otro motivo de preocupación relacionado con las mutaciones es la falta de alineación de los cebadores diseñados para la realización de PCR con la secuencia de algunas de las nuevas variantes lo que supondría una pérdida de sensibilidad de la técnica. En este sentido se han comunicado pequeños grados de variabilidad en la mayoría de las regiones reconocidas por los cebadores incluidos en el listado de la OMS. Aunque se considera que la mayoría de las mutaciones detectadas no tienen un impacto relevante, determinados cebadores se han visto afectados por una mayor frecuencia de falta de emparejamiento subrayando la importancia de la vigilancia de la variabilidad y la conveniencia del uso de más de una diana en los ensayos diagnósticos.
La iniciativa GISAID, que promueve el rápido intercambio de información respecto a los virus influenza y el coronavirus causante de la COVID, alberga en su plataforma más de 83000 secuencias de SARS-CoV-2 en estos momentos (108) Las distintas variantes del genoma del virus pueden clasificarse filogenéticamente en diferentes clados, que son grupos de variantes que comparten un antepasado común. Existen varias nomenclaturas para designar a los posibles clados. La propuesta por GISAID reconoce 6 clados en los que es posible clasificar el 95% de las secuencias almacenadas en su plataforma (108). Cada uno de ellos es nombrado con una letra representativa de alguna de las mutaciones que definen el clado:
S: C8782T,T28144C incluye NS8-L84S
L: C241,C3037,A23403,C8782,G11083,G25563,G26144,T28144,G28882 (WIV04-secuencia de referencia)
V: G11083T,G26144T NSP6-L37F + NS3-G251V
G: C241T,C3037T,A23403G incluye S-D614G
GH: C241T,C3037T,A23403G,G25563T incluye S-D614G + NS3-Q57H
GR: C241T,C3037T,A23403G,G28882A incluye S-D614G + N-G204R
Estos clados se corresponden aproximadamente con los definidos por Hodcroft et al. siguiendo una nomenclatura de tipo año-letra según el siguiente esquema: S-19B, L y V-19A, G20A, GH-20C, GR-20B. La distribución geográfica en las primeras fases de la pandemia mostraba una mezcla más homogénea de los diferentes clados y se correspondía en buena medida con la secuencia temporal de aparición de las nuevas variantes a lo largo de la expansión del virus. Los Información científica-técnica. Enfermedad por coronavirus, COVID-19 28 de agosto de 2020 clados 19A y 19B surgieron en Wuhan y dominaron al principio del brote. El clado 20A deriva del 19A y dominó la expansión en Europa en el mes de marzo. Los clados 20B y 20C son subclados derivados de 20A. A medida que los diferentes países fueron implementando restricciones a los viajes internacionales se fue afianzando la distribución geográfica de algunas variantes reflejando una mayor relevancia de la transmisión local. En los últimos meses en España predomina el clado 20 A (incluye la mutación S-D614G)
2.4. Fisiopatología covid
2.4.1 Interacción con el sistema renina-angiotensina-aldosterona
El SARS-CoV-2 penetra en la célula empleando como receptor a la enzima convertidora de angiotensina 2 (ACE-2 por sus siglas en inglés), una exopeptidasa de membarana presente fundamentalemtne en el riñón, los pulmones y el corazón (123). La función de la ACE2 es la trasformación de la Angiotensina I en Angiotensina 1-9 y de la Angiotensina II en Angiotensina 1- 7. Estos productos finales tienen efectos vasodilatadores, antifibrosis, antiinflamatorios y favorecen la natriuresis. Son todos efectos, por tanto, que reducen la tensión arterial, contrarregulando la acción de la Angiotensina II. La ACE2 se ha relacionado con la protección frente a la hipertensión, la arteriosclerosis y otros procesos vasculares y pulmonares. En modelos animales se ha visto que la ausencia de ACE2 da lugar a un mayor daño pulmonar en el SDRA y la sobrexpresión del ACE2 protege frente al mismo (124–127). Por el contrario, la enzima convertidora de la Angiotensina (ACE), que transforma la Angiotensina I en Angiotensina II, favorece la generación de péptidos secundarios con efecto vasoconstrictor, proinflamatorio y de retención de sodio, que se relacionan con la fisiopatología de la hipertensión arterial. Se ha observado que los casos graves de COVID-19 presentan niveles de Angiotensina II muy elevados. Y el nivel de Angiotensina II se ha correlacionado con la carga viral de SARS-CoV-2 y el daño pulmonar. Este desequilibrio del sistema renina-angiotensina-aldosterona podría estar en relación con la inhibición de la ACE2 por parte del virus (129). Este mismo efecto ya fue observado en el brote producido por SARS en 2003.
2.4.2 Interacción con el sistema inmunitario
Origen y transmision coronavirus mundo
La infección por SARS-CoV-2 activa el sistema inmune innato generando una respuesta excesiva que podría estar relacionada con una mayor lesión pulmonar y peor evolución clínica. Las observaciones clínicas apuntan a que, cuando la repuesta inmune no es capaz de controlar eficazmente el virus, como en personas mayores con un sistema inmune debilitado, el virus se propagaría de forma más eficaz produciendo daño tisular pulmonar, lo que activaría a los macrófagos y granulocitos y conduciría a la liberación masiva de citoquinas pro-inflamatorias.
Un equipo de investigación de China ha descrito el circuito de activación de esta vía inmunitaria partir de la activación de linfocitos T helper (Th) CD4+ y CD8+ aberrantes (con mayor expresión de marcadores inflamatorios, comparados con controles sanos). En pacientes con neumonía por SARS-CoV-2 ingresados en UCI comparados con los no ingresados en UCI, y con controles sanos, observaron correlación con una mayor proporción células T CD4+ productoras de IL-6 y GM-CSF (factor estimulante de las colonias de granulocitos-macrófagos con la gravedad de los casos de Información científica-técnica. Enfermedad por coronavirus, COVID-19 28 de agosto de 2020 (COVID-19 (135). Otros estudios han observado la presencia de niveles elevados de IL-6 y otras citoquinas proinflamatorias en pacientes con COVID-19 grave (136–138). Esta hiperactivación sin embargo resulta insuficiente para controlar la infección y conduce a una depleción linfocitaria asociada a un mayor daño tisular, que es observable clínicamente en pacientes graves que presentan linfopenia e hiperferritinemia (139). Esta hiperactivación se ha denominado síndrome de liberación de citoquinas (CRS, por sus siglas en inglés), que estaría asociada al síndrome de insuficiencia respiratoria aguda o Síndrome de Distrés Respiratorio del Adulto (SDRA) que se ha descrito como la principal causa de mortalidad por COVID-19. Figura 11. Evolución temporal de los clados predominates en España, desde diciembre de 2019 a junio de 2020: azul 19A, turquesa 19B, verde: 20A, amarillo 20B, naranja 20C. Fuente: Nexstrain.org.
El CRS se produce cuando se activan grandes cantidades de leucocitos (neutrófilos, macrófagos y mastocitos) y liberan grandes cantidades de citoquinas proinflamatorias (142). El CRS se describió inicialmente como un efecto adverso de terapias con anticuerpos monoclonales, y es frecuente también en las terapias con células CART (células T con receptor de antígeno quimérico)(143). Las principales citoquinas implicadas en la patogénesis del CRS incluyen la interleuquina (IL)-6, la IL10, el interferón (IFN), la proteína quimiotáctica de monocitos 1 (MCP-1) y el factor estimulante de las colonias de granulocitos-macrófagos (GM-CSF); otras citoquinas como el factor de necrosis tumoral (TNF), IL-1, IL-2, IL-2-receptor- e IL-8 también se han descrito durante el CRS. El CRS se ha observado en otras infecciones virales como SARS, MERS o Ébola, aunque a través de la alteración de distintas vías. En pacientes con COVID-19 su patogénesis aún no se conoce totalmente, sin embargo se ha observado una mayor concentración plasmática de varias citoquinas (IL-1β, IL-6, IL2, IL-2R, IL7, IL10, GSCF, IP10, MCP1 MIP1A, TNFα, etc.), fundamentalmente en pacientes con cuadros más graves.
2.4.2 Interacción con la coagulación y el sistema microvascular
La activación excesiva del sistema inmune innato que causa tormentas de citoquinas ocasiona daño del sistema microvascular y activa el sistema de coagulación e inhibición de la fibrinólisis. La Información científica-técnica. Enfermedad por coronavirus, COVID-19 28 de agosto de 2020 coagulación intravascular diseminada (CID) conduce a trastornos generalizados de la microcirculación que contribuyen a la situación de fallo multiorgánico. Se ha observado que los niveles de antitrombina son menores en casos de COVID-19, y los niveles de dímero D y fibrinógeno son mayores que en población general. Además, la progresión de la gravedad de la enfermedad va ligada a un aumento gradual del dímero D. Estos hallazgos apoyan la teoría del desarrollo de una coagulopatía de consumo en infecciones por SARS-CoV-2, y que cuando estas ocurren empeora el pronóstico (146). Aunque el mecanismo no está completamente establecido, hay varias causas que pueden contribuir a este fenómeno. La IL6 desempeña un papel importante en la red de mediadores inflamatorios y puede causar trastornos de la coagulación a través de diversas vías, como la estimulación hepática para la síntesis de trombopoyetina y fibrinógeno, aumento de la expresión del factor de crecimiento endotelial vascular, expresión de los factores tisulares de los monocitos y la activación del sistema de coagulación extrínseco. La trombina generada a su vez puede inducir al endotelio vascular a producir más IL-6 y otras citoquinas. Las tormentas de citoquina y los trastornos de la coagulación de este modo se retroalimentan (144,147). El principio del tratamiento con tocilizumab sería inhibir la IL-6 para revertir el efecto de la tormenta de citoquinas y los trastornos de la coagulación asociados (148). Se ha observado también la alteración de las plaquetas por varias vías: daño indirecto mediante invasión de las células madre hematopoyéticas de la médula ósea o daño directo mediante la activación del complemento (144). Además, la inflamación producida en el pulmón junto con la hipoxia de los casos con neumonía, causa la agregación plaquetaria y la trombosis, con un aumento de consumo de las plaquetas. Todos estos factores contribuyen a desencadenar el estado de hipercoagulabilidad que se observa en los casos de COVID-19 (149).
2.5. Estacionalidad
En el inicio de la epidemia, se teorizó acerca de si el SARS-CoV-2 tendría un patrón estacional al igual que ocurre con otros virus respiratorios como la gripe o los coronavirus causantes de los catarros comunes. Estimando el intervalo serial y calculando el número básico de reproducción diario, en más de 100 ciudades chinas con más de 40 casos, se observó una relación lineal inversa con la temperatura y la humedad. Por cada aumento en un grado Celsius y 1% de humedad, el R0 se redujo 0,0383 y 0,0224, respectivamente (150). Del mismo modo, investigadores de EEUU e Irán observaron una expansión geográfica mundial desde China a otras regiones con una distribución predominante en un corredor estrecho entre los meridianos 30-50 N´´, con patrones climáticos similares (5-11º C y 47-79% humedad). En lugares más próximos a China, con mayor intercambio de personas, como India, la expansión no se produjo del mismo modo, lo que apoyó la hipótesis del patrón estacional (151). Otro grupo observó la correlación inversa de la trasmisión del SARS-CoV-2 con la temperatura, ajustando por la capacidad de vigilancia de los países. Aunque estas observaciones son importantes, también hay que tener en cuenta el resto de factores que influyen en la transmisión en el curso de esta epidemia, como la alta susceptibilidad a la infección de la población en su conjunto y la relajación de las medidas de distanciamiento Información científica-técnica. Enfermedad por coronavirus, COVID-19 28 de agosto de 2020 social con la llegada del verano (153). Del mismo modo, durante los meses fríos, la temperatura no es el único factor que influye en la mayor transmisión, sino también las actividades en espacios cerrados con poca ventilación y el hacinamiento. Durante estos meses, las enfermedades respiratorias, típicamente se amplifican a partir de la transmisión de los niños en los colegios, los adultos en los centros de trabajo, celebraciones y reuniones en domicilio.


